私たち生物は生命を維持するために、体内で様々な化学反応(代謝)を行っています。代謝は、DNAに記録されている遺伝情報を元に合成(発現)された転写関連タンパク質によって行われます。生物はこれらのタンパク質を必要な時に、必要な分だけ発現することで、代謝を厳密に制御しています。この遺伝子発現の制御メカニズムの異常は、癌や遺伝子疾患などの発症の要因になります。私たちはこのメカニズムを解明するため、コンピュータ上でタンパク質の構造変化を追跡する分子動力学(MD)シミュレーションを用いて研究を行っています。
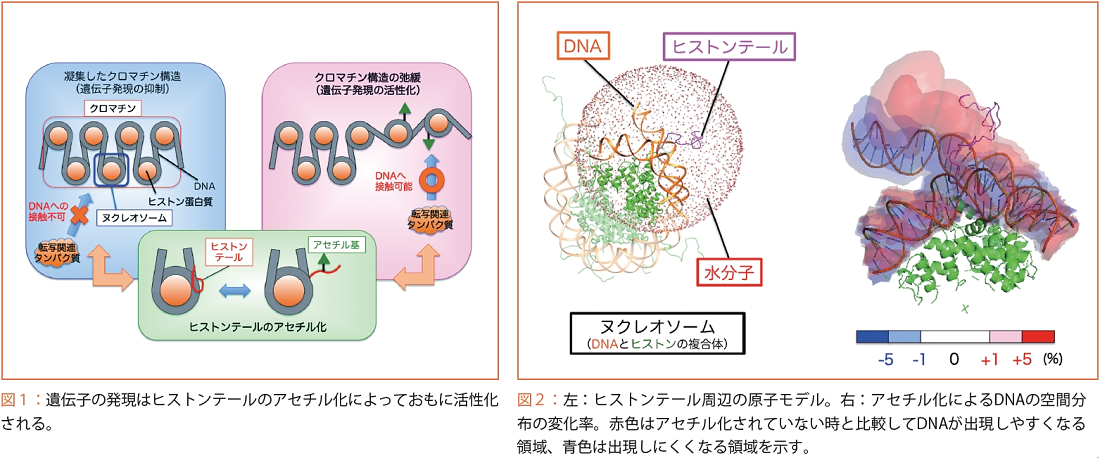
ヒトの細胞の中では、DNAはヒストンタンパク質に巻きついたヌクレオソーム、さらに多数のヌクレオソームが集まったクロマチンと呼ばれる構造を作っています。凝集したクロマチン構造が形成されている時は、転写関連タンパク質はDNAに接触して遺伝情報を読むことができないため、発現を行うことができません。一方、ヒストンの末端部分(ヒストンテール)にアセチル基が付加(アセチル化)されると、クロマチン凝集が緩み、遺伝子の発現が活性化されます(図1)。この遺伝子発現のオン、オフのスイッチの仕組みを理解するには、アセチル化によってヒストンテールの構造がどのように変化するかを調べることが必要です。しかしヒストンテールは、天然変性状態と呼ばれる多数の構造をとるため、結晶構造解析やNMRなどの実験的な方法で分子構造を詳細に調べることができません。また、プラスの電荷を持ったヒストンテールは、マイナスの電荷を持ったDNAに電気的な力で強く張り付いてしまうため、従来のMDシミュレーション手法ではヒストンテールのとりうる様々な構造を十分に調べることができませんでした。
私たちは、スーパーコンピュータ「京」のプロジェクトにおいて新たなMDシミュレーション手法、ALSD法を開発しました。この手法は、ヒストンテールの電荷をシミュレーション中に変化させることによって、DNAへの張り付きを解消し、様々なヒストンテールの構造を調べることを可能にしました。その結果、アセチル化はヒストンテールをコンパクトな構造にすることで、ヒストンに巻きついたDNAを解けやすくしてクロマチンの構造変化を促進すること(図2)や、アセチル基が転写関連タンパク質を誘導するための目印として積極的にヌクレオソームの表面に露出することなど、従来の実験やシミュレーション計算で解明することのできなかったヒストンテールの詳細な姿を、スーパーコンピュータの計算パワーを用いて初めて明らかにしました。今後はさらなる遺伝子発現メカニズムの解明に取り組み、ALSD法を用いた創薬開発などの応用に向けて研究を展開していく予定です。
実験で見えない分子の形を計算で見る
-ヒストンテールの構造探索-
|
![]()
ZOOM IN 課題3 パーキンソン病の症状再現に向けた神経系 -筋骨格系の統合シミュレーション
ZOOM IN 課題4 がんゲノムビッグデータのスーパーコンピュータ解析から生命科学・医療へ




















