本課題では、ポスト「京」における分子動力学シミュレーションを最大の効率で実行するために必要な高度化とアルゴリズム開発を行います。創薬応用のためには様々な問題規模の分子動力学シミュレーションが必要となります。数万原子から十万原子程度の小規模な系でのタンパク質・リガンド結合状態の予測シミュレーション、百万原子以内の膜タンパク質やタンパク質複合体のダイナミクスに加えて、ウィルスや細胞環境を考慮した生体系などでは一千万原子を超える大規模な系を長時間計算しなければなりません。ポスト「京」でこれらの問題を扱うためには、ハードウェア設計とソフトウェア設計の両面から強調して設計作業をすすめ、全体としての計算効率を最適化する手法、すなわち、コデザインが行われています。私たちは理研を中心に開発した分子動力学ソフトウェアGENESISに関するコデザインを、重点課題1、理研計算科学研究機構、富士通株式会社で連携して行っています。小・中規模な系に対してはパラメータやリガンドを変えたシミュレーションをポスト「京」において多数同時に実行できるように、大規模な系に対してはポスト「京」の全ノードを用いて複雑で大規模な計算限界に挑戦できるようにしたいと考えています。高度化されたGENESISに、重点課題1で開発された新しい創薬応用分子動力学アルゴリズムを導入することによって、ポスト「京」を用いて分子動力学計算や創薬応用に必要な自由エネルギー解析を簡便に、そして高速に実現可能にしていきます。また、開発したソフトウェアや計算手法がポスト「京」の稼働と同時に一般ユーザーでも利用できるように公開し、利用を促進します。
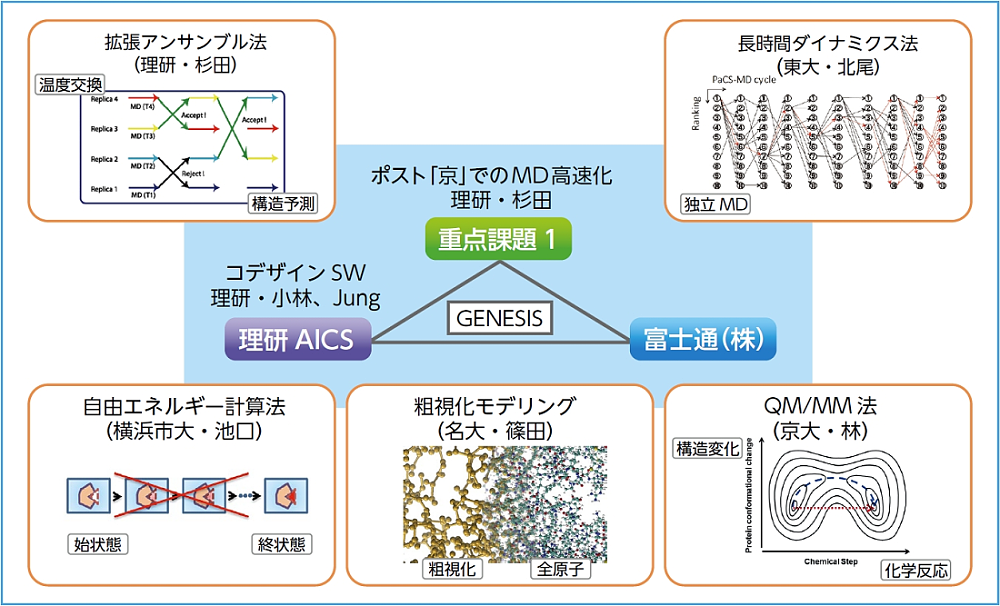
サブ課題A「ポスト「京」でのMD高度化とアルゴリズム深化」では、コデザインにより分子動力学プログラムGENESISをポスト「京」に向けて高度化するとともに、先端的なMDアルゴリズムを順次導入していく。
ポスト「京」で設定された9つの重点課題の1つである「生体分子システムの機能制御による革新的創薬基盤」がこれから本格的に走りだそうとしています。私は、その中で、サブ課題B「次世代創薬計算技術の開発」の責任者を担当させていただくことになりました。このサブ課題Bは、サブ課題Aで開発するポスト「京」に最適化された分子シミュレーションソフトウエアやアルゴリズムを高度に活用し、サブ課題Cで開発する計算創薬統合システムに繋げることを目指して、これまでの計算能力では難しかった創薬計算や構造生物学計算に果敢に挑戦しようとする課題です。具体的には、まず、創薬標的タンパク質の運動や構造変化に着目した動的分子機能制御を目標としました。これまでの計算創薬では、「鍵と鍵穴」モデルにのっとって、標的となるタンパク質の構造は堅く動かないものとして扱う計算方法がしばしば用いられています。しかし、実は、タンパク質の構造はとても柔らかく、医薬品等低分子の結合などに際して構造変化もよく起こします。本課題では、ポスト「京」の持つ膨大な計算能力を活かして、標的タンパク質の運動や構造変化の様子まで捉え、それを制御することを目指しています。次の課題は、タンパク質間相互作用や核酸-タンパク質間相互作用の制御です。最近では、抗体医薬など、タンパク質自体を医薬品とするバイオ医薬品も作られています。そのようなタンパク質や核酸は、低分子化合物と比較して格段に複雑であり、しかも、その立体構造は柔軟なので、それら分子間の相互作用を詳細に計算するには、ポスト「京」を活かした大規模計算を行わねばなりません。さらには、ウイルスキャプシド全体計算や、複数の生体超分子が複雑に絡み合った環境である細胞環境を標的とした計算も課題としています。これらの対象は、実に超巨大系で、世界をリードするスパコンで初めて計算可能となるような前人未到のチャレンジングなテーマです。このように、計算だけでも魅力的な研究課題ですが、実験系計測と連携を密にすることで研究価値は増加します。本課題では、最先端の構造生物学実験施設であるSPring8やNMR施設と連携しながら研究を進めていくことを計画しています。以上のように、ポスト「京」を活用して、今までにないような創薬計算が実現できればと期待しています。
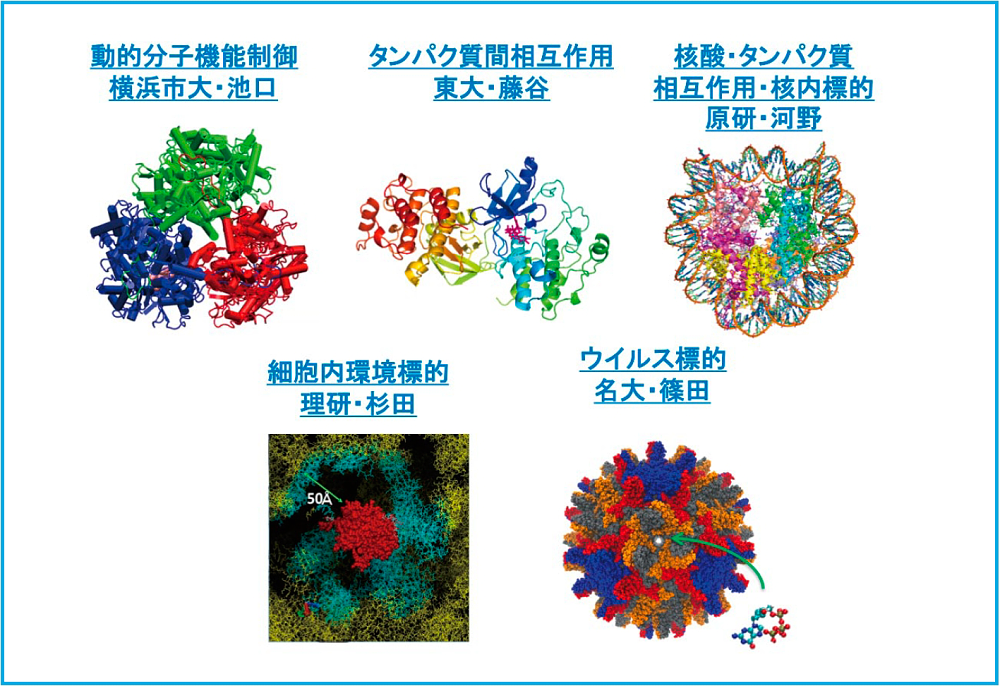
サブ課題B「次世代創薬計算技術の開発」の対象の概要。
動的分子機能制御、タンパク質間相互作用制御、核酸‒タンパク質相互作用制御、核内環境標的、細胞内環境標的、ウイルス標的の各テーマからなる。
![]()
重点課題(1) 生体分子システムの機能制御による革新的創薬基盤の構築
重点課題(2) 個別化・予防医療を支援する統合計算生命科学




















