
マルチスケール・マルチフィジックス
心臓シミュレータUT-Heart
東京大学新領域創成科学研究科
(左から) 久田 俊明、杉浦 清了、鷲尾 巧、岡田 純一、高橋 彰仁
(臓器全身スケールWG)





ヒトの心臓はATP(アデノシン三リン酸)加水分解による生化学反応をエネルギー源として、電気(イオン電流、興奮伝播、心電図など)・化学(物質輸送、反応、エネルギー変換など)・力学(心筋張力、 血圧、血流など)の諸現象に広く派生するマルチフィジックス問題を構成する。また空間尺度としては、タンパク分子( ~ 10nm) から細胞( ~ 100μm)、組織( ~ mm)、臓器( ~ cm) を経て血液拍出に至るマルチスケール問題を構成している。
ATPは、一つの心筋細胞内に5, 60本存在する筋原線維を構成する沢山のアクチンフィラメントとミオシンフィラメントの間の相対的滑り運動のためのエネルギーとして消費される。フィラメントの相対滑りはミオシンフィラメントから延びるミオシン分子のヘッドがアクチンフィラメントに結合して牽引力を与えることにより生じるが、その具体的な機構に関する仮説は多様性に富み未だ議論に終止符は打たれていない。図1右はミオシンヘッドの首振り説を示す。一方、心肥大は弁膜症や高血圧など心臓が高い血圧を発生しなければならない状況に適応するために壁厚(心筋の断面積)を増やす現象と理解されているが、肥大型心筋症と呼ばれる疾患では血圧は正常で肥大する理由がないのに壁が厚くなる。初期の検討ではミオシン分子が点突然変異(代表的なものとしてアクチン分子との結合部位に当る403番目のアミノ酸の変異がある)し心機能が落ちるのでこれを代償するために肥大すると理解されたが、その後の研究では変異ミオシンはむしろ機能が亢進していることが報告された[1]。では機能の亢進したミオシンが混ざると心臓に何が起きるのか。
私達はこれまで超並列計算機による心臓のマルチスケール解析技術を開発してきたが[2]、現在は “京”を用いて本格的にこの問題に取り組んでいる。 即ち、従来は計算機パワーの限界からアクチン分子とミオシン分子の確率的結合状態は平均的な一分子を考え、これを状態遷移を表す方程式に適用して解かざるを得なかったが[3]、超並列計算機の特徴を活かせば図1に示すように、分子内の弾性要素をばねでモデル化した一つひとつのミオシンヘッドの確率的運動を具体的にシミュレートするところから、細胞の収縮を経て、組織、臓器の運動までをシームレスに解くことが出来るようになった。ミオシンヘッドの運動には、例えば一つのミオシンヘッドがアクチンフィラメントと結合すると近隣のミオシヘッドも結合し易くなる“協調性(Cooperativity)”と呼ばれる特徴が知られるが、本計算モデルではこのような特徴もありのままに導入することが出来、また前記の機能の亢進したミオシンが混じった場合についての心拍動の様子も調べることが可能となる。具体的手順は次のようになる。(1)ミクロスケールにおけるミオシン分子の協調性をともなう確率的な振る舞いを直接モンテカルロ法でシミュレートする。(2)細胞間隙などを含む細胞のメゾスケール構造体モデル内の筋肉線維部に上記モンテカルロモデルを埋め込み、スケール間の力学的相互作用を物理的に正しく取り扱う。(3)上記2次構造体モデルとマクロスケール臓器モデルの運動を均質化法により結び付ける。
以上のような解析法の実現により、分子レベルでの状態変化の法則および 細胞組織レベルでの各構造体が心臓の拍動性能やエネルギー効率にどのような影響を与えているのか、逆にマクロ的な筋肉の収縮弛緩がフィードバックされて分子レベルでの状態変化にどのような影響を及ぼしているのか、などをシミュレーションを通じて分析することが可能となった。このようなシミュレーションプラットフォームは今後、分子生物学者が自分の仮説を新たな観点から検証する手段にもなると考えられる。
UT-Heartの研究開発・検証は、富士通(株)次世代テクニカルコンピューティング本部(門岡良昌アプリケーション統括部長のグループ)、東京大学医学部附属病院(永井良三客員教授のグループ)と共同で行われている。また臨床研究は東京大学医学系研究科倫理委員会の承認のもとになされている。
【参考文献】
[1] Belus A, Piroddi N, Scellini B, Tesi C, Amati GD, Girolami F, Yacoub M, Cecchi F, Olivotto I, Poggesi C, The familial hypertrophic cardiomyopathy-associated myosin mutation R403Q accelerates tension generation and relaxation of human cardiac myofibrils, J Physiol, 586(Pt 15), 3639-3644, 2008
[2] Hosoi A, Washio T, Okada J, Kadooka Y, Nakajima K, Hisada T, A Multi-Scale Heart Simulation on Massively Parallel Computers, SC10, NewOrleans, proceedings 1-11, 2010
[3] Washio T, Okada J, Sugiura S, Hisada T, Approximation for Cooperative Interactions of a Spatially-detailed Cardiac Sarcomere Model, Cellular and Molecular Bioengineering, 5, 113-126, 2012
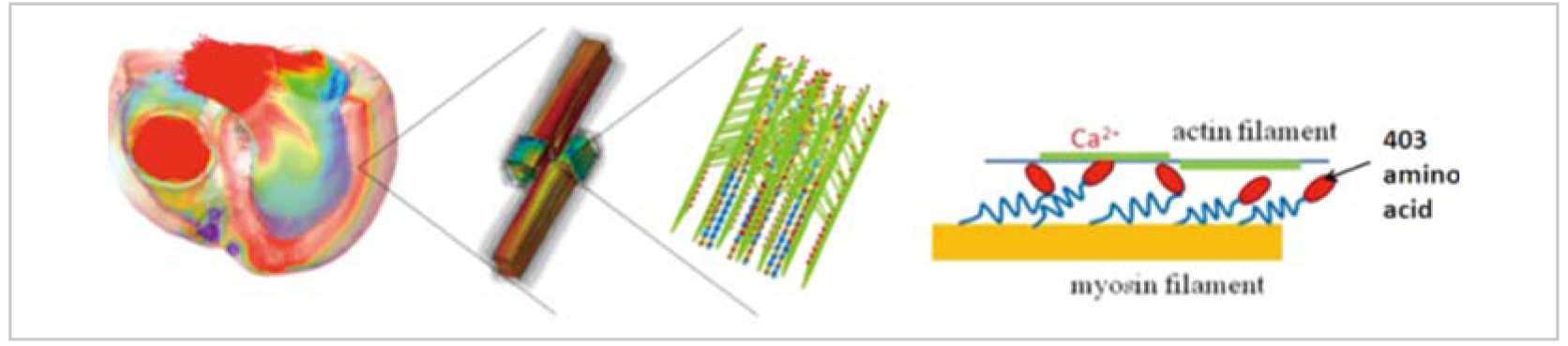
図1:京によるサルコメア動力学からの心拍動マルチスケールシミュレーション
BioSupercomputing Newsletter Vol.8
- SPECIAL INTERVIEW
- 革新的なアプローチでライフサイエンス分野の未来を切り拓いてきたグランドチャレンジ
理化学研究所 次世代計算科学研究開発プログラム
プログラムディレクター 茅 幸二 - ライフサイエンス分野の研究開発に革新をもたらした画期的なプロジェクト
理化学研究所 次世代計算科学研究開発プログラム
副プログラムディレクター 姫野 龍太郎
- 研究報告
- マルチスケール・マルチフィジックス心臓シミュレータUT-Heart
東京大学新領域創成科学研究科
久田 俊明、杉浦 清了、鷲尾 巧、岡田 純一、高橋 彰仁
(臓器全身ケールWG) - 膵臓β細胞内インスリン顆粒動態シミュレーション・モデル
神戸大学大学院システム情報学研究科 玉置 久(細胞スケールWG) - 京による全脳シミュレーションへの道のり
理化学研究所 脳科学総合研究センター ユーリッヒ研究センター
神経科学・医療研究院(INM-6)
アーヘン工科大学医学部 マーカス・ディースマン(脳神経系WG) - 大規模並列用MDコアプログラムの開発
理化学研究所 次世代計算科学研究開発プログラム 大野 洋介(開発・高度化T)
- SPECIAL INTERVIEW
- 循環器系および筋骨格系・脳神経系における階層統合シミュレーションの実現をめざす
東京大学大学院工学系研究科機械工学専攻 教授 高木 周(課題3 代表) - 最先端シークエンサーによる大規模データを「京」で解析し生命プログラムとその多様性の理解を進める
東京大学医科学研究所ヒトゲノム解析センター 教授 宮野 悟(課題4代表)
- 報告
- 「4th Biosupercomputing Symposium」の開催報告
理化学研究所 次世代計算科学研究開発プログラム 田村 栄悦 - 京互換機:SCLS計算機システムの導入
理化学研究所 HPCI計算生命科学推進プログラム チーム員 木戸 善之
