●最初に、お二人が現在の研究に取り組むことになった経緯についてお話しください。
山下
高校時代に数学で物理現象を記述することの面白さを実感し、研究の道に進んでからもずっと計算科学を続けてきました。もともと量子力学に興味があり、プロトンの研究をしていましたが、バイオ分野でもプロトンが大事な役割を果たす現象がたくさんあることから、そちらに応用展開していこうと米国で分子生物学などバイオ関連の研究に携わり、タンパク質の研究を行ったのがこちらに来るきっかけでした。タンパク質のシミュレーションが病気を治す薬の開発という、自分が考えていたよりも幅広く活用できることに興味を持ち、チャレンジすることに決めました。自分の研究が医療という社会の重要課題に直接つながるというのはやりがいもありますし、少しでも貢献できれば、自分にとっても喜ばしいことですから。2011年1月にこちらに来て、バイオシミュレーションや薬に関連するタンパク質をターゲットにした分子動力学計算による研究を進めてきました。
篠田
私は、大学時代は物理の相転移という現象にとても魅力を感じて最初は実験の研究室に入り、放射光を用いた合金のX線回折実験を中心に研究を行っていました。実験では滅多に見られない現象を実際に間近に目にすることができたりして非常にエキサイティングでしたが、一方でその現象がなぜどのように起きるのか、もっとモデル研究や理論に踏み込んでいきたいという思いもありました。修士、博士課程は別々の大学院に進み、修士課程では希釈強磁性体の相転移を、博士課程では量子液体の積分方程式の研究を行いました。MDシミュレーションを用いた研究は産総研のポスドク時代に初めて行いました。その後企業のポスドクとして材料開発や量子化学計算など、いろいろなことをやってきましたが、いつも中途半端な感じが否めなく、自分でじっくり考えて仮説を立て、深く研究に踏み込んでいくことがなかなかできないことにフラストレーションがたまっていました。そんなとき、こちらに採用が決まりました。ちょうど、山下さんが入る1カ月前、2010年の12月でした。スーパーコンピュータを使って生体分子のMDシミュレーションを行い、その構造やダイナミクスを調べて薬の開発に役立てる研究は、目的が明快で、出口に直結しているところに面白さとやりがいを感じました。また、一緒に研究を行うウェットの先生方も、計算科学の成果を活かして薬を開発したいという思いに溢れています。シミュレーション研究が、ダイレクトに薬の開発に活用されるというのは大きなプレッシャーですが、ぜひ実現させたいという気持ちです。
●お二人は、課題2でどのような研究に取り組んでおられるのですか。
山下
課題2で私がまず手掛けたのは、キナーゼを阻害する分子標的薬の研究です。多くの薬は、病気の原因となるタンパク質の機能を抑えることで薬としての役割を果たします。
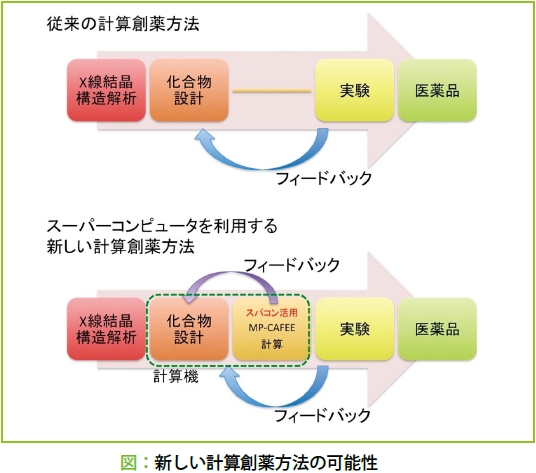
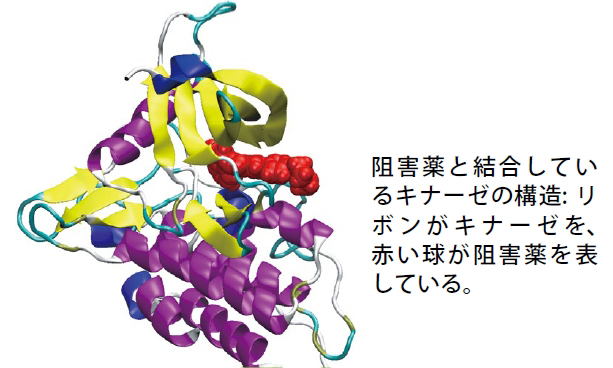 薬を見つけるためには、生体内の標的タンパク質と強く相互作用する化合物を探し出す必要があります。そこでスーパーコンピュータによるシミュレーションによって、標的タンパク質と化合物の結合自由エネルギーを評価し、薬として有望な化合物を見つけ出そうというわけです。結合自由エネルギーは、分子がどれくらい標的タンパク質を認識できるかを示す物理量の1つです。私たちは「京」を使って、藤谷らが開発した「MP-CAFEE」という結合自由エネルギー計算法により、高い精度で新規の薬候補化合物の活性予測を行い、阻害活性の高い化合物の設計・探索を進めています。ちなみに、「MP-CAFEE」のエンジンともいうべきMDプログラムは、オープンソースで開発されている「GROMACS」で、これをストックホルム大学などの開発者らの協力で「京」向けにチューニングし、初期に比べて計算効率がおよそ2倍に向上しました。この高速化で結合自由エネルギー計算は、さらに効率よく実行できるようになっています。これによって、有望な薬候補化合物を見つけ出すための技術的な基盤が整い、昨年あたりから大規模なデータが蓄積されはじめ、それをベースに新たな創薬の可能性を吟味した論文も出せるようになりました。これからは、たくさん計算した結果をしっかり解析して、サイエンスとしての成果を出していくことが、私たちの大事なミッションになると思っています。
薬を見つけるためには、生体内の標的タンパク質と強く相互作用する化合物を探し出す必要があります。そこでスーパーコンピュータによるシミュレーションによって、標的タンパク質と化合物の結合自由エネルギーを評価し、薬として有望な化合物を見つけ出そうというわけです。結合自由エネルギーは、分子がどれくらい標的タンパク質を認識できるかを示す物理量の1つです。私たちは「京」を使って、藤谷らが開発した「MP-CAFEE」という結合自由エネルギー計算法により、高い精度で新規の薬候補化合物の活性予測を行い、阻害活性の高い化合物の設計・探索を進めています。ちなみに、「MP-CAFEE」のエンジンともいうべきMDプログラムは、オープンソースで開発されている「GROMACS」で、これをストックホルム大学などの開発者らの協力で「京」向けにチューニングし、初期に比べて計算効率がおよそ2倍に向上しました。この高速化で結合自由エネルギー計算は、さらに効率よく実行できるようになっています。これによって、有望な薬候補化合物を見つけ出すための技術的な基盤が整い、昨年あたりから大規模なデータが蓄積されはじめ、それをベースに新たな創薬の可能性を吟味した論文も出せるようになりました。これからは、たくさん計算した結果をしっかり解析して、サイエンスとしての成果を出していくことが、私たちの大事なミッションになると思っています。
私自身はもともとベーシックな研究をしてきて、そこにいちばん大きなモチベーションがあるので、創薬応用研究を進めながらも、それに付随して基礎的な現象の不思議な側面や、また明らかになっていないことに引き寄せられる部分もあります。実戦に向けてどんどん応用が進む一方で、ベーシックな部分で、まだ不十分なところも実はたくさん残されています。全てがパーフェクトな手法として完成したわけではありません。アカデミアであるからには、これからもさらなる探究を続けていく必要があります。そのために、実際の計算を行って結果を出していくとともに、そうした側面の研究も続けていくという、レンジの広い研究を、現在はやっています。
篠田
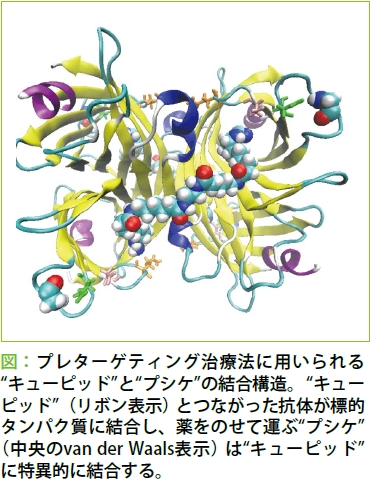
私が取り組んでいるのは、化学合成の低分子化合物より分子量が大きく構造も複雑な抗体医薬の開発に向けた研究です。抗体医薬は、抗原と呼ばれる標的タンパク質に特異的に強く相互作用する抗体を薬として応用するもので、バイオ医薬の1つです。抗体そのものが薬になることもありますし、他の化合物やタンパク質と組み合わせることにより治療を行うこともあります。例えばプレターゲティング法のように、抗体でがんの位置を特定し、抗体につないだタンパク質と特異的に結合する化合物に薬をのせて運んで治療するというような方法に応用されることもあります。いずれにせよ、抗体と標的タンパク質との親和性、つまり抗原とくっつく強度を高めることが非常に重要になります。現在は扱っている抗体の親和性の向上を目指すことと、もう少しベーシックな部分、具体的には、抗原-抗体がどのように結合するのかをシミュレーションで調べています。というのも、扱っている抗体が非常に特殊で、抗原を認識するところにプロリンという残基があり、それが認識する前と結合した後で立体構造が変化(シス-トランス構造変異)するのです。その変化にはものすごくエネルギーが必要で、それがいろいろな生物学的なプロセスのスイッチを担っているともいわれています。この転移のメカニズムをMDシミュレーションで直接見るのは時間がかかりすぎて難しいのですが、何かそのメカニズムを知る手掛かりが得られれば、抗原を認識する部分の設計に結び付けることができるのではないかと考えています。
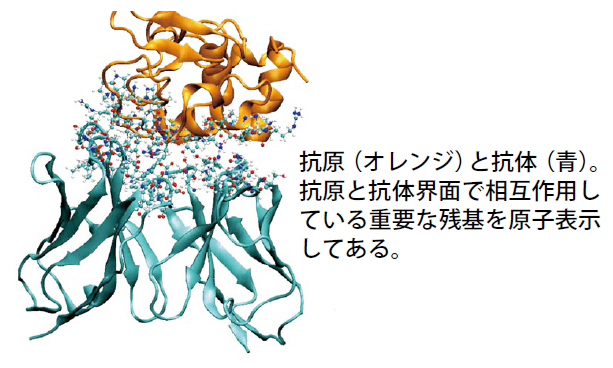 結合過程や結合構造を明らかにするために、「京」を使ってMDシミュレーションを1,000本近く、それもいろいろな軌道を描きながら結合するようにして試みました。数多く流すことによって、いろいろな場合を見ながら推測していこうというわけです。このような基礎的なメカニズムの解明は生物学的にも非常に重要で、後に必ず薬の開発にも結び付くと考えています。
結合過程や結合構造を明らかにするために、「京」を使ってMDシミュレーションを1,000本近く、それもいろいろな軌道を描きながら結合するようにして試みました。数多く流すことによって、いろいろな場合を見ながら推測していこうというわけです。このような基礎的なメカニズムの解明は生物学的にも非常に重要で、後に必ず薬の開発にも結び付くと考えています。
●いよいよ最終年度に入りましたが、これまでの成果を踏まえて、今年度はどのように研究を進めていきたいとお考えですか。

山下
先ほどもお話ししたように、高速で計算する手法が整い、1つのテーマに200以上の化合物を計算するといった大規模なチャレンジを行ってきました。今後はより詳しい解析を通して、「なぜそうなるのか」を明らかにするための方法をブラッシュアップしていくことが重要だと考えています。そうすることで、例えばキナーゼ阻害薬にしても、より効率よく設計・探索が可能になるはずです。また、シミュレーション成果を創薬に結び付けていくためには、実験の存在も大きいと考えています。どれだけシミュレーションが頑張っても、やはりシミュレーションはある意味で現実の模倣であり、あくまでも予測です。現実により近付けていくためには、いろいろな段階で、きちんとした実験や検証を重ね合わせて、シミュレーションとリアリティの整合性を検証することが必要です。その繰り返しがシミュレーションの高精度化につながりますし、創薬プロセス全体の高速化・効率化にも大いに役立つはずです。
実験とシミュレーションの関係について、若い人たちに勘違いしないでほしいのは、実験に合わせてシミュレーションを行っているのではないということです。モデルはあくまでも物理ベースで、純粋に理論から組み立てられています。実験の存在も大きいといったのは、結果を都合よく実験に合わせるためではなく、モデルが現実をよく再現していないところを見つけてアップデートしていくためです。いわば実験は答え合わせのようなもので、なぜ合わないのかを見つけ出すために大切なのです。そこはとても重要で、シミュレーション研究でいちばん頑張らなければいけないところです。
そうしたことも考えながら、今年度は担当している主要なテーマを成果に結び付けるとともに、手法やメソッドをよりブラッシュアップさせていきながら、新しいクエスチョンに応えるためのシミュレーションを付け加えていくこともやっていきたいと思っています。シミュレーションの成果は、一方で次の実験の人たちに引き渡すわけですが、私の手の内にも成果は残るわけで、それを将来の解析技術の向上に役立てたり、興味深いタンパク質の性質を理解するヒントが得られたりすれば、もっと面白くなるはずです。すでにできている手法をそのまま動かすだけでなく、自分の頭を使って、もっと発展させていくことができれば、それは素晴らしいことですよね。場合によっては、結合自由エネルギーだけでなく、そこにプラスすることによってより高い成果が得られる技法があるかもしれません。アルゴリズムも同様です。これまでは高速化が中心でしたが、もっと他にできることがあるはずです。たとえば、活性予測の切り口を変えることで、有効な薬候補化合物のバリエーションを広げることができるかもしれません。今すぐには役に立たないかもしれませんが、それらを次の世代、次のチャレンジで活かしてもらえるような考え方や理論としてしっかり残していくことも、私たちの大事なミッションであると思っています。
篠田
昨年、「京」を使って水を含めた系で初期運動量を変えて1,000本近いMDシミュレーションを実施し、その直接のアウトプットである時系列データの解析を途中まで進めました。今はその解析の続きをやっていますが、その解析の結果をしっかりとまとめるのが今年度の仕事かなと思っています。先ほど山下さんから「GROMACS」が「京」で動くようになった話が出ましたが、私はその恩恵を大いに受けて、とても楽をさせていただきました。それでもMD計算はたいへんな作業で、気は遣いました。特に初期のころの「京」は、データが100%出てくることがあまりなく、途中で止まってしまったり、エラーが出てデータがダメになるなどトラブルもありました。最終的には1,200本近く流して1,000本弱のデータが揃いました。また、首尾よくデータが得られても、それが完全なデータかというと問題もあって、そのチェックも苦労しました。とにかくこれほどの大規模計算は自分でも初めてのことで、はじめのうちは、どこをチェックすれば成果を引き出すためのデータセットとして使えるのかもまだよく分かっていない状態でした。それでもとにかくチェックを終えて、少なくとも1,000本弱は大丈夫というところまでこぎつけました。解析はまだ途中ですが、結合までの時間や結合している時間・回数もさまざまで、結合しないものもあるなど、いろいろな動きが見えています。抗原・抗体の結合過程を、ここまで大規模にシミュレーションした例は、おそらくこれまでなかったと思います。その意味でも、この成果から結合プロセスのダイナミクスをしっかりと見ていきたいと考えています。
●5年後、10年後を見据えて、今後どのような研究に取り組んでいきたいとお考えですか。
山下
研究のスパンからいうと、おそらく1つのテーマに取り組んで、ある答えにたどり着くまでに、5年くらいは普通にかかりますよね。そう考えると、10年というのもけっして遠い先のことではありませんね。私ははじめにお話ししたように、もともと物理的なメカニズムに興味があって、バイオロジーだけをずっと続けていきたいというわけではありませんが、今はタンパク質や細胞のなかの分子の振る舞いなどが次々に明らかにされ、バイオシミュレーションも大きく発展しようとしています。非常に面白い分野だと思っています。その意味でも、今後は1つのタンパク質だけでなく、タンパク質の集団を取り扱うシミュレーションや、特殊な働きをするタンパク質などを見ていき、そのなかから面白い物理を探っていくという研究を続けていきたいと考えています。もちろん生体分子を扱う限りは、実際の医療とも切り離せませんから、医療に役立つようなシミュレーション研究もやっていきたい。例えば、病気の原因を明らかにするような研究もその1つですね。やはり糸口はいろいろな病気にあるように思います。タンパク質のちょっとした違いで、思いもよらない重篤な症状につながることもあります。小さな設計ミス、組み立てミスが何を引きおこすのかを分子・原子レベルで解明していくということが、これからもっと重要になるはずです。そこに貢献していきたいと思っています。

篠田
今はまだ1つの抗体しか扱っていませんが、5年後くらいには、抗体のシミュレーションのことなら何でも分かる、そんな職人というかスペシャリストになりたいというのが、1つの目標です。かつて、企業のポスドクに就いていたころ、上司が量子化学の専門家だったのですが、その人は分子構造を見ただけで、「これ、どこか間違ってるぞ。何か気持ちが悪い」といって誤りを直感的に見つけてしまうんです。私は驚いて「なぜ分かるんですか」と聞いたら、「分子の気持ちになれば、分かるんだよ」と話していました。私もそんな風に、分子シミュレーションの可視化映像を見ただけで、「このあたりを動かしたら、もっと結合する抗体になるぞ」くらいのことが言えるようになりたいですね。さらに、抗体の研究を通して、医療にも貢献できるような、重要な現象のメカニズムの解明に取り組んでいきたいと思っています。それから、もちろん今後もコンピュータシミュレーション技術を活かした計算科学的な研究も行っていきますが、例えば統計力学など、もっと別のアプローチでバイオロジーの世界と向き合ってみたいという気持ちもあります。これはまだ漠然とした思いでしかないのですが。


 薬を見つけるためには、生体内の標的タンパク質と強く相互作用する化合物を探し出す必要があります。そこでスーパーコンピュータによるシミュレーションによって、標的タンパク質と化合物の結合自由エネルギーを評価し、薬として有望な化合物を見つけ出そうというわけです。結合自由エネルギーは、分子がどれくらい標的タンパク質を認識できるかを示す物理量の1つです。私たちは「京」を使って、藤谷らが開発した「MP-CAFEE」という結合自由エネルギー計算法により、高い精度で新規の薬候補化合物の活性予測を行い、阻害活性の高い化合物の設計・探索を進めています。ちなみに、「MP-CAFEE」のエンジンともいうべきMDプログラムは、オープンソースで開発されている「GROMACS」で、これをストックホルム大学などの開発者らの協力で「京」向けにチューニングし、初期に比べて計算効率がおよそ2倍に向上しました。この高速化で結合自由エネルギー計算は、さらに効率よく実行できるようになっています。これによって、有望な薬候補化合物を見つけ出すための技術的な基盤が整い、昨年あたりから大規模なデータが蓄積されはじめ、それをベースに新たな創薬の可能性を吟味した論文も出せるようになりました。これからは、たくさん計算した結果をしっかり解析して、サイエンスとしての成果を出していくことが、私たちの大事なミッションになると思っています。
薬を見つけるためには、生体内の標的タンパク質と強く相互作用する化合物を探し出す必要があります。そこでスーパーコンピュータによるシミュレーションによって、標的タンパク質と化合物の結合自由エネルギーを評価し、薬として有望な化合物を見つけ出そうというわけです。結合自由エネルギーは、分子がどれくらい標的タンパク質を認識できるかを示す物理量の1つです。私たちは「京」を使って、藤谷らが開発した「MP-CAFEE」という結合自由エネルギー計算法により、高い精度で新規の薬候補化合物の活性予測を行い、阻害活性の高い化合物の設計・探索を進めています。ちなみに、「MP-CAFEE」のエンジンともいうべきMDプログラムは、オープンソースで開発されている「GROMACS」で、これをストックホルム大学などの開発者らの協力で「京」向けにチューニングし、初期に比べて計算効率がおよそ2倍に向上しました。この高速化で結合自由エネルギー計算は、さらに効率よく実行できるようになっています。これによって、有望な薬候補化合物を見つけ出すための技術的な基盤が整い、昨年あたりから大規模なデータが蓄積されはじめ、それをベースに新たな創薬の可能性を吟味した論文も出せるようになりました。これからは、たくさん計算した結果をしっかり解析して、サイエンスとしての成果を出していくことが、私たちの大事なミッションになると思っています。
 結合過程や結合構造を明らかにするために、「京」を使ってMDシミュレーションを1,000本近く、それもいろいろな軌道を描きながら結合するようにして試みました。数多く流すことによって、いろいろな場合を見ながら推測していこうというわけです。このような基礎的なメカニズムの解明は生物学的にも非常に重要で、後に必ず薬の開発にも結び付くと考えています。
結合過程や結合構造を明らかにするために、「京」を使ってMDシミュレーションを1,000本近く、それもいろいろな軌道を描きながら結合するようにして試みました。数多く流すことによって、いろいろな場合を見ながら推測していこうというわけです。このような基礎的なメカニズムの解明は生物学的にも非常に重要で、後に必ず薬の開発にも結び付くと考えています。





















